作者:江伟
2018年7月,长春长生疫苗事件一度全国瞩目,直至长春长生被处以91亿顶格处罚、14名责任人被终生禁业乃至刑事处罚!
2019年6月29日,《中华人民共和国疫苗管理法》历经三审正式发布,将自2019年12月1日起施行,一度被冠以“史上最严格管理制度”的称号。
《疫苗管理法》的火速出台,可以说在汲取长春长生疫苗事件、武汉生物疫苗事件、山东济南疫苗事件等惨痛教训的基础上,更是在总结了《药品管理法》、《疫苗流通和预防接种管理条例》(以下简称《条例》)、《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)实施经验的基础上,针对疫苗监管的特殊性,举一反三、堵塞漏洞,特别系统制定了疫苗研制、生产、流通、预防接种管理制度,下面主要从五个方面予以重点介绍。
一、严格的研制管理
1、不得使用来源不明的菌毒株和细胞株
《疫苗管理法》第11条明确规定“疫苗研制、生产、检验等过程中应当建立健全生物安全管理制度。疫苗研制、生产、检验等使用的菌毒株和细胞株,应当明确历史、生物学特征、代次,建立详细档案,保证来源合法、清晰、可追溯;来源不明的,不得使用。”
2、疫苗临床试验审批不适用“默示许可”制
为贯彻上述42号文,2018年7月24日,国家药品监督管理局发布《关于调整药物临床试验审评审批程序的公告》,正式实施药物临床试验“默示许可”制,即在中国申报药物临床试验的,自申请受理并缴费之日起60日内,未收药审中心否定或质疑意见的,申请人可按照提交的方案开展药物临床试验。
与一般药物临床试验不同的是,《疫苗管理法》第16条明确规定“开展疫苗临床试验,应当经国务院药品监督管理部门依法批准”。这表明疫苗的临床试验仍遵循明示批准制,不适用“默示许可”制度。
3、临床试验实施机构的要求更为严格
在临床试验实施机构方面,42号文明确规定“具备临床试验条件的机构在食品药品监管部门指定网站登记备案后,可接受药品医疗器械注册申请人委托开展临床试验。临床试验主要研究者应具有高级职称,参加过3个以上临床试验。”然《疫苗管理法》第11条规定“疫苗临床试验应当由符合国务院药品监督管理部门和国务院卫生健康主管部门规定条件的三级医疗机构或者省级以上疾病预防控制机构实施或者组织实施”。由此可见,针对疫苗临床试验,《疫苗管理法》特意提高了临床试验机构的等级,未达规定要求的一般药物临床试验机构不得实施。
二、严格的上市管理
1、严格准入,实行捆绑
现阶段MAH制度正在如火如荼地试行,而《疫苗管理法》第22条却明确规定“疫苗上市许可持有人应当具备疫苗生产能力;超出疫苗生产能力确需委托生产的,应当经国务院药品监督管理部门批准。” 这与现行有效的《药品委托生产监督管理规定》中规定的“生物制品不得委托生产。国家食品药品监督管理总局可以根据监督管理工作需要调整不得委托生产的药品”保持一致。因此,对于疫苗,中国仍然实行药品上市许可与生产许可捆绑制,也即不具备疫苗生产能力的研究机构、科研人员不可能成为疫苗上市许可持有人。
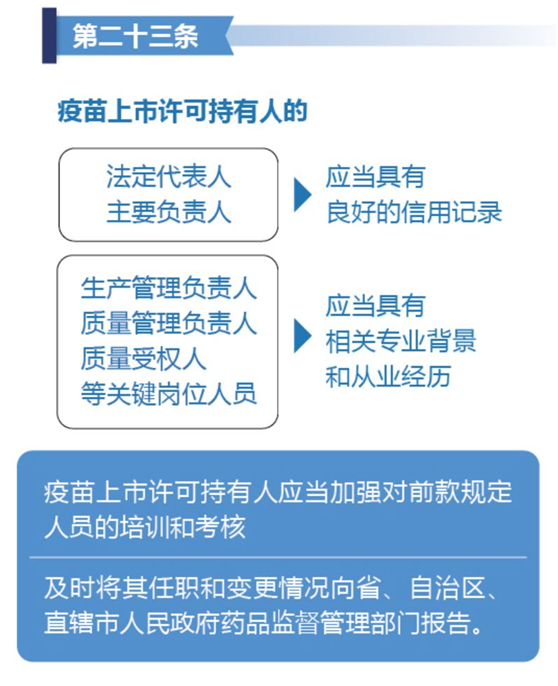
与此同时,国家对疫苗上市许可人及其责任人员实行严于一般药品生产企业的准入制度,具体如下图所示:
* 图片来源参考文献2
2、批签发制度
虽然《生物制品批签发管理办法》已经明确“未通过批签发的生物制品,不得上市销售或者进口”,但是《疫苗管理法》再次从法律的高度强调“国家实行疫苗批签发制度”、“不予批签发的疫苗不得销售,并应当由省级或者口岸所在地药品监督管理部门监督销毁或者依法进行其他处理”。另外,除批签发机构具备重大质量风险报告责任外,《疫苗管理法》还在《生物制品批签发管理办法》的基础上,增加疫苗上市许可人的质量风险报告义务——对生产工艺偏差、质量差异、生产过程中的故障和事故以及采取的措施,疫苗上市许可持有人应当如实记录,并在相应批产品申请批签发的文件中载明;可能影响疫苗质量的,疫苗上市许可持有人应当立即采取措施,并向省级药品监督管理部门报告。
三、严格的流通管控
1、统一采购
《疫苗管理法》沿袭了《条例》中统一采购的监管框架,但是又有区别。《条例》中的第一类疫苗和第二类疫苗分别对应《疫苗管理法》中的“免疫规划疫苗”(指居民应当按照政府的规定接种的疫苗,包括国家免疫规划确定的疫苗,省、自治区、直辖市人民政府在执行国家免疫规划时增加的疫苗,以及县级以上人民政府或者其卫生健康主管部门组织的应急接种或者群体性预防接种所使用的疫苗)和“非免疫规划疫苗”(指由公民自费并且自愿受种的其他疫苗)。对于国家免疫规划确定的疫苗,《疫苗管理法》规定由国务院卫生健康主管部门会同国务院财政部门等组织集中招标或者统一谈判,形成并公布中标价格或成交价格,各省实行统一采购;除此以外的其他疫苗由各省、自治区、直辖市通过省级公共资源交易平台组织采购。
2、供应配送
虽然两票制已经在全国推行,但是根据《条例》和《疫苗管理法》可知,疫苗的供应和配送环节实行更为严格的“一票制”:
《条例》规定:疫苗生产企业应当向省级疾病预防控制机构或者其指定的其他疾病预防控制机构供应第一类疫苗,疫苗生产企业应当直接向县级疾病预防控制机构配送第二类疫苗,不得向其他单位或者个人供应。
《疫苗管理法》规定:疫苗上市许可持有人应当向疾病预防控制机构或者疾病预防控制机构指定的接种单位配送疫苗。疾病预防控制机构应当按照规定向接种单位供应疫苗。疾病预防控制机构以外的单位和个人不得向接种单位供应疫苗,接种单位不得接收该疫苗。
当然,疫苗上市许可持有人、疾病预防控制机构可以选在自行配送或者委托配送,负责配送的单位应当具备疫苗冷链储运和运输条件条件。疫苗在储存、运输全过程中应当处于规定的温度环境,冷链储存、运输应当符合要求,并定时监测、记录温度。接收或者购进疫苗时,应当索取本次运输、储存全过程温度监测记录,并保存至疫苗有效期满后不少于五年备查。相比于《条例》记录保存时间足足延长了三年。
3、退市淘汰
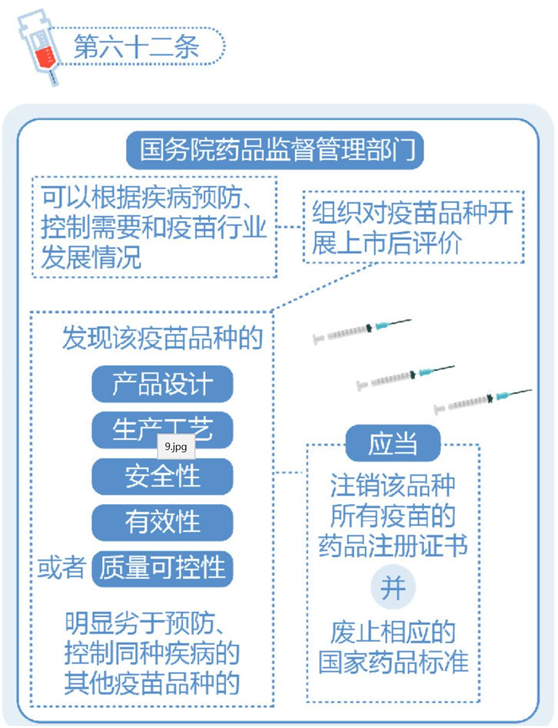
《疫苗管理法》第七章为疫苗上市后管理,明确要求“疫苗上市许可持有人应当建立健全疫苗全生命周期质量管理体系,制定并实施疫苗上市后风险管理计划,开展疫苗上市后研究”。对于疫苗的退市,《疫苗管理法》主要提出了以下三种情形:
1)对批准疫苗注册申请时提出进一步研究要求的疫苗(主要指附条件批准上市的疫苗,具体详见《疫苗管理法》第20条),疫苗上市许可持有人应当在规定期限内完成研究;逾期未完成研究或者不能证明其获益大于风险的,国务院药品监督管理部门应当依法处理,直至注销该疫苗的药品注册证书。
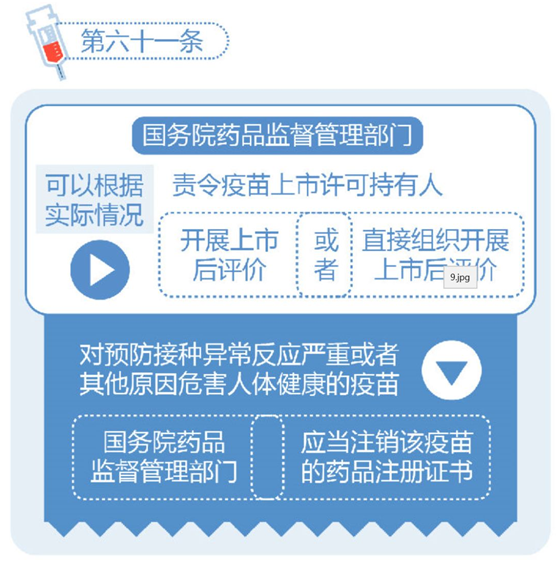
2)对预防接种异常反应严重或者其他原因危害人体健康的疫苗,国务院药品监督管理部门应当注销该疫苗的药品注册证书。

.png)
.png)
.png)
.png)